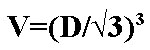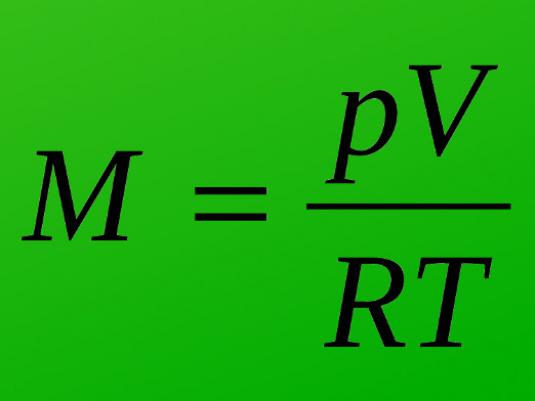Comment trouver le volume de gaz?

Avant de résoudre les problèmes, il est nécessaire de prendre en compte les formules etLes règles de la façon de trouver le volume de gaz. Cela vaut la peine de se souvenir de la loi d'Avogadro. Et le volume de gaz lui-même peut être calculé à l'aide de plusieurs formules, en choisissant parmi celles-ci une quantité appropriée. Lors du choix de la formule nécessaire, les conditions environnementales, en particulier la température et la pression, sont d'une grande importance.
La loi d'Avogadro
Il dit qu'à la même pression etla même température, dans les mêmes volumes de gaz différents, contiendra le même nombre de molécules. Le nombre de molécules de gaz contenues dans une mole est le nombre d'Avogadro. Il résulte de cette loi que: 1 kmol de gaz parfait, et quel qu'il soit, à la même pression et à la même température (760 mm Hg et t = 0 * C) occupe toujours un volume = 22,4136 m3.
Comment déterminer le volume de gaz
- La formule V = n * Vm est la plus souvent trouvéetâches. Ici, le volume de gaz en litres est V, Vm est le volume de gaz molaire (l / mol), qui dans des conditions normales est de 22,4 l / mol, et n est la quantité de matière en moles. Quand il n'y a pas de quantité de substance dans les conditions, mais il y a une masse de matière, alors nous procédons comme suit: n = m / M. Ici, M est g / mol (la masse molaire de la substance), et la masse de la substance en grammes est m. Dans le tableau périodique, il est écrit sous chaque élément, comme sa masse atomique. Nous ajoutons toutes les masses et obtenons le requis.
- Alors, comment calculer le volume de gaz. Voici le problème: dissoudre 10 grammes d'aluminium dans l'acide chlorhydrique. Question: combien d'hydrogène peut se distinguer quand n. y? L'équation de réaction est la suivante: 2Al + 6HCl (g) = 2AlCl3 + 3H2. Au tout début, on trouve de l'aluminium (quantité), réagi selon la formule: n (Al) = m (Al) / M (Al). Nous prenons la masse d'aluminium (molaire) de la table de Mendeleyev M (Al) = 27 g / mol. Nous substituons: n (Al) = 10/27 = 0,37 mol. Il ressort de l'équation chimique que 3 moles d'hydrogène se sont formées lorsque deux moles d'aluminium ont été dissoutes. Il devrait être calculé, et combien d'hydrogène sera libéré de 0,4 moles d'aluminium: n (H2) = 3 * 0,37 / 2 = 0,56 mol. Nous remplaçons les données dans la formule et trouvons le volume de ce gaz. V = n * Vm = 0,56 * 22,4 = 12,54L.